Torstai, 4. heinäkuuta 2013. 15 vuoden lupausten, pettymysten ja poliittisten esteiden jälkeen kantasolut alkavat antaa tuloksia, ja Japanista on jo nousemassa uusi johtava uusiutuvan lääketieteen maailma. Viime viikolla julkistettua ensimmäisen kliinisen tutkimuksen sokeiden verkkokalvojen regeneroimiseksi japanilaiset biologit rikkovat tänään pankin joidenkin ihmisen maksanpunkojen kanssa, jotka on valmistettu laboratoriossa iPS-kantasoluista ja jotka tutkimuksen asiantuntijoiden mukaan Ne ovat ratkaiseva askel kohti uudenlaista hoitoa maksan potilaille, jotka kuolevat elinsiirtojen hännässä.
Tekniikka voi viedä noin 10 vuotta klinikalle pääsyyn, mutta se on osoitus syntyvän uudistavan lääketieteen perusteista: elinten ja kudosten valmistus, jotka voidaan siirtää potilaille monenlaisten parantumattomien sairauksien hoitamiseksi. Viimeisimmän lääketieteellisen Nobel-palkinnon Shinya Yamanakan löytö iPS-kantasoluista on motivoinut Japania sijoittamaan parhaat tieteelliset voimavaransa regeneratiivisen lääketieteen kehittämiseen ja kliiniseen soveltamiseen.
IPS-solut ovat tämän biolääketieteellisen tutkimuksen alan suuri lupaus. Sen päävaihtoehto kaikelle, mitä tähän saakka tunnetaan, on alkion kantasolut (ESC, englanninkielisten alkioiden alkukirjaimilla), jotka olivat vuonna 1998 tämän tutkimuskentän suuri käynnistin, mutta myös he ovat ansainneet uskonnollisen kieltäytymisen ihmisalkioiden hankkimisesta kahden viikon ajan ennen istutusta kohtuun. IPS-solut toisaalta saadaan viivästyttämällä yksinkertaisten ihosolujen kelloa (ohjelmointi uudelleen žargonissa) siten, että ne palauttavat kantasolujensa esi-ikäisen luonteen.
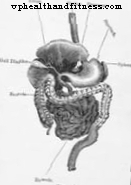
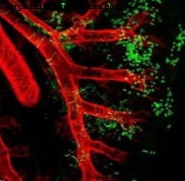
Takanori Takebe ja hänen kollegansa Yokohaman kaupungin yliopiston lääketieteellisessä korkeakoulussa Japanissa esittävät huomenna luonnossa tutkimuksen, jolla vaaditaan merkittäviä tieteellisiä vaikutuksia lähitulevaisuudessa. He ovat onnistuneet tuottamaan ensimmäistä kertaa "vaskularisoidun kolmiulotteisen ihmisen elimen", erityisesti maksan, iPS-kantasoluviljelmistä. Osoittaakseen, että se toimii, he ovat siirtäneet sen humanisoituihin hiiriin tai valmistautuneet olemaan hylkäämättä implanttia. Mutta siirretty maksa on ihminen. Kuten ihminen kuin ihminen, josta ihosolu poistettiin, Nobel Yamanaka -tekniikoilla tuli iPS-soluviljelmä.
Tämän tekniikan kliininen soveltaminen ei ole välitöntä: Takebe itse arvioi sen saapuvan 10 vuodessa, mikä on tieteellinen tapa sanoa "En tiedä". Japanin tutkijoiden tuottamat maksankeltuaiset ovat täysin ihmisiä, mutta luvan saaminen niiden siirtämiseksi potilaalle vaatii silti monia protokollia ja joitain erittäin tärkeitä.
Ensinnäkin tutkijoiden on osoitettava, että iPS-soluista johtuvat riskit (geneettinen epävakaus, syöpäpohjan mahdollisuus) eivät ole suurempia kuin implantin hyödyt. Hiirikokeissa Takebe ja hänen kollegansa eivät ole havainneet mitään näistä ongelmista, mutta on selvää, että se ei riitä.
Kansallisen elinsiirtojärjestön (ONT) johtaja Rafael Matesanz pitää japanilaisten työtä "erittäin mielenkiintoisena". "Vaikka iPS-solut ovat vielä yksi tutkimuslinja muun muassa", hän sanoo, "ja kunnes tiedämme mikä on paras, kaikkia niitä on seurattava samanaikaisesti, alkion kantasolut ja biomekaaniset rakenteet mukaan lukien, kuten parhaillaan tutkimalla keinotekoisten henkitorven tekemistä. "
Mikäli tämä tekniikka tai muu vastaava tekniikka saavuttaisi kliinisen käytännön, mikä olisi sen merkitys elinluovutusten johtajana toimivan Espanjan kaltaisessa maassa? "Tällä hetkellä maksansiirron odotuslistalla on 1100 potilasta. 6–8% kuolee sitä odottaessa", Matesanz sanoi. Se on 60–80 kuollutta, mutta maan suurin elinsiirtoasiantuntija korostaa, että tätä lukua ei pidä pitää maksa-elinsiirtolähteen hyödyllisyyden indeksinä. "Jos maksa olisi kaksinkertainen, niin kysyntä kaksinkertaistuu", Matesanz sanoo.
Lääkärit ja kirurgit ovat täysin tietoisia siitä, kuinka paljon maksaa - joko elävää tai kuollutta luovuttajaa - on saatavana, ja jos Espanja johtaa maailman luovuttajien luokitusta, siellä olisi aina riittävästi tilaa elinsiirtojen kasvulle. Esimerkiksi leviävää syöpää sairastavat potilaat suljetaan pois potentiaalisina vastaanottajana, kun luovutuksia on niukasti, mutta heidät otettaisiin mukaan yhä enemmän, jos terveydenhuoltojärjestelmä löytäisi uuden elinlähteen tai elimiä käyttävät asiat.
Japanilaisten maksankeltuaisten mahdolliset sovellukset eivät ole rajoittuneet tuleviin elinsiirtoihin. Matesanz huomauttaa kahdesta mahdollisuudesta, jotka todennäköisesti tulevat ennen näitä kirurgisia toimenpiteitä. "Yksi on kokeilla uusia lääkkeitä", sanoo ONT: n johtaja. Tämä on erityisen mielenkiintoinen mahdollisuus maksan kanssa, joka on elin, joka metaboloi vieraita aineita kehossa, mukaan lukien lääkkeet. Uuden molekyylin toksisuuden tutkiminen maksankeltuaisten viljelmissä voisi merkittävästi helpottaa testejä, jotka sen on läpäistävä, kunnes se saavuttaa kliinisen sovelluksensa tai ei.
Ja toinen mahdollinen lyhytaikainen käyttö on hoito maksasolujen viljelmillä tai maksasoluilla. Ei keltuaisten tai kolmiulotteisten elinten kanssa, vaan pelkkien maksasolujen kanssa kulttuurissa, jotka ovat yksi sen ainesosista. "Se on harvinainen terapeuttinen vaihtoehto, mutta sitä käytetään jo kliinisessä käytännössä", Matesanz sanoo. Sitä käytetään toisinaan pitämään potilas hengissä, kunnes hengenpelastuselin saapuu, tai hoitamaan lapsia, joilla on metabolisia puutteita tai perinnöllisiä sairauksia, joista puuttuu biologinen entsyymi tai katalyytti. Maksasolut tarjoavat tässä tapauksessa normaalit entsyymit, joista lapselta puuttuu.
Lähde:
Tunnisteet:
Wellness Perhe Sukupuoli
Tekniikka voi viedä noin 10 vuotta klinikalle pääsyyn, mutta se on osoitus syntyvän uudistavan lääketieteen perusteista: elinten ja kudosten valmistus, jotka voidaan siirtää potilaille monenlaisten parantumattomien sairauksien hoitamiseksi. Viimeisimmän lääketieteellisen Nobel-palkinnon Shinya Yamanakan löytö iPS-kantasoluista on motivoinut Japania sijoittamaan parhaat tieteelliset voimavaransa regeneratiivisen lääketieteen kehittämiseen ja kliiniseen soveltamiseen.
IPS-solut ovat tämän biolääketieteellisen tutkimuksen alan suuri lupaus. Sen päävaihtoehto kaikelle, mitä tähän saakka tunnetaan, on alkion kantasolut (ESC, englanninkielisten alkioiden alkukirjaimilla), jotka olivat vuonna 1998 tämän tutkimuskentän suuri käynnistin, mutta myös he ovat ansainneet uskonnollisen kieltäytymisen ihmisalkioiden hankkimisesta kahden viikon ajan ennen istutusta kohtuun. IPS-solut toisaalta saadaan viivästyttämällä yksinkertaisten ihosolujen kelloa (ohjelmointi uudelleen žargonissa) siten, että ne palauttavat kantasolujensa esi-ikäisen luonteen.
Takanori Takebe ja hänen kollegansa Yokohaman kaupungin yliopiston lääketieteellisessä korkeakoulussa Japanissa esittävät huomenna luonnossa tutkimuksen, jolla vaaditaan merkittäviä tieteellisiä vaikutuksia lähitulevaisuudessa. He ovat onnistuneet tuottamaan ensimmäistä kertaa "vaskularisoidun kolmiulotteisen ihmisen elimen", erityisesti maksan, iPS-kantasoluviljelmistä. Osoittaakseen, että se toimii, he ovat siirtäneet sen humanisoituihin hiiriin tai valmistautuneet olemaan hylkäämättä implanttia. Mutta siirretty maksa on ihminen. Kuten ihminen kuin ihminen, josta ihosolu poistettiin, Nobel Yamanaka -tekniikoilla tuli iPS-soluviljelmä.
Tämän tekniikan kliininen soveltaminen ei ole välitöntä: Takebe itse arvioi sen saapuvan 10 vuodessa, mikä on tieteellinen tapa sanoa "En tiedä". Japanin tutkijoiden tuottamat maksankeltuaiset ovat täysin ihmisiä, mutta luvan saaminen niiden siirtämiseksi potilaalle vaatii silti monia protokollia ja joitain erittäin tärkeitä.
Ensinnäkin tutkijoiden on osoitettava, että iPS-soluista johtuvat riskit (geneettinen epävakaus, syöpäpohjan mahdollisuus) eivät ole suurempia kuin implantin hyödyt. Hiirikokeissa Takebe ja hänen kollegansa eivät ole havainneet mitään näistä ongelmista, mutta on selvää, että se ei riitä.
Kansallisen elinsiirtojärjestön (ONT) johtaja Rafael Matesanz pitää japanilaisten työtä "erittäin mielenkiintoisena". "Vaikka iPS-solut ovat vielä yksi tutkimuslinja muun muassa", hän sanoo, "ja kunnes tiedämme mikä on paras, kaikkia niitä on seurattava samanaikaisesti, alkion kantasolut ja biomekaaniset rakenteet mukaan lukien, kuten parhaillaan tutkimalla keinotekoisten henkitorven tekemistä. "
Mikäli tämä tekniikka tai muu vastaava tekniikka saavuttaisi kliinisen käytännön, mikä olisi sen merkitys elinluovutusten johtajana toimivan Espanjan kaltaisessa maassa? "Tällä hetkellä maksansiirron odotuslistalla on 1100 potilasta. 6–8% kuolee sitä odottaessa", Matesanz sanoi. Se on 60–80 kuollutta, mutta maan suurin elinsiirtoasiantuntija korostaa, että tätä lukua ei pidä pitää maksa-elinsiirtolähteen hyödyllisyyden indeksinä. "Jos maksa olisi kaksinkertainen, niin kysyntä kaksinkertaistuu", Matesanz sanoo.
Lääkärit ja kirurgit ovat täysin tietoisia siitä, kuinka paljon maksaa - joko elävää tai kuollutta luovuttajaa - on saatavana, ja jos Espanja johtaa maailman luovuttajien luokitusta, siellä olisi aina riittävästi tilaa elinsiirtojen kasvulle. Esimerkiksi leviävää syöpää sairastavat potilaat suljetaan pois potentiaalisina vastaanottajana, kun luovutuksia on niukasti, mutta heidät otettaisiin mukaan yhä enemmän, jos terveydenhuoltojärjestelmä löytäisi uuden elinlähteen tai elimiä käyttävät asiat.
Japanilaisten maksankeltuaisten mahdolliset sovellukset eivät ole rajoittuneet tuleviin elinsiirtoihin. Matesanz huomauttaa kahdesta mahdollisuudesta, jotka todennäköisesti tulevat ennen näitä kirurgisia toimenpiteitä. "Yksi on kokeilla uusia lääkkeitä", sanoo ONT: n johtaja. Tämä on erityisen mielenkiintoinen mahdollisuus maksan kanssa, joka on elin, joka metaboloi vieraita aineita kehossa, mukaan lukien lääkkeet. Uuden molekyylin toksisuuden tutkiminen maksankeltuaisten viljelmissä voisi merkittävästi helpottaa testejä, jotka sen on läpäistävä, kunnes se saavuttaa kliinisen sovelluksensa tai ei.
Ja toinen mahdollinen lyhytaikainen käyttö on hoito maksasolujen viljelmillä tai maksasoluilla. Ei keltuaisten tai kolmiulotteisten elinten kanssa, vaan pelkkien maksasolujen kanssa kulttuurissa, jotka ovat yksi sen ainesosista. "Se on harvinainen terapeuttinen vaihtoehto, mutta sitä käytetään jo kliinisessä käytännössä", Matesanz sanoo. Sitä käytetään toisinaan pitämään potilas hengissä, kunnes hengenpelastuselin saapuu, tai hoitamaan lapsia, joilla on metabolisia puutteita tai perinnöllisiä sairauksia, joista puuttuu biologinen entsyymi tai katalyytti. Maksasolut tarjoavat tässä tapauksessa normaalit entsyymit, joista lapselta puuttuu.
Lähde: