1 tabletti pow. sisältää 2 mg syproteroniasetaattia ja 0,035 mg etinyyliestradiolia. Valmiste sisältää laktoosia ja sakkaroosia.
| Nimi | Pakkauksen sisältö | Vaikuttava aine | Hinta 100% | Viimeksi muokattu |
| OC-35 | 3 x 21 kpl, pöytä pow. | Syproteroniasetaatti, Etinyyliestradioli | 33,02 PLN | 2019-04-05 |
Toiminta
Yhdistetty valmiste, joka sisältää etinyyliestradiolia - estrogeenia ja syproteroniasetaattia - gestageenia, jolla on antiandrogeenisiä ominaisuuksia. Syproteroniasetaatti estää kilpailevasti androgeenien sitoutumisen kohde-elinten reseptoreihin ja estää epäsuorasti androgeenien tuotantoa munasarjoissa ja lisämunuaisissa. Tämän toiminnan kliininen vaikutus on liiallisen androgeeniaktiivisuuden vaikutusten eliminointi - aknen oireiden häviäminen (noin 4 syklin jälkeen), seborrean normalisoituminen, kasvojen hiusten häviäminen ja hiustenlähtöjen väheneminen miesten kaljuuntumisessa (saavutettu 6-10 syklin jälkeen). Syproteroniasetaatilla on antiandrogeenisen vaikutuksen lisäksi myös progestogeeninen vaikutus. Sitä tulisi käyttää yhdessä etinyyliestradiolin kanssa, koska pelkkä syproteroniasetaatti voi johtaa sykehäiriöihin. Etinyyliestradioli on synteettinen estradiolijohdannainen, jota käytetään kaikissa hormonihäiriöissä, joihin naispuolinen sukupuolihormonihoito on tarkoitettu. Suun kautta annettuna syproteroniasetaatti imeytyy täydellisesti laajalla annosalueella. Syproteroniasetaatin maksimipitoisuus plasmassa tapahtuu 1,6 tuntia annon jälkeen. Sitten sen pitoisuus pienenee kahdessa vaiheessa, joissa T0,5 on 0,8 ja 2,3 päivää. Syproteroniasetaatti metaboloituu useiden metaboliareittien kautta. Tärkein metaboliitti plasmassa on 15β-hydroksyylijohdannainen.Syproteroniasetaatilla on affiniteetti rasvakudokseen ja se kertyy siihen ja vapautuu sitten vähitellen. Metabolian jälkeen maksassa se erittyy kokonaan: 1/3 virtsaan ja 2/3 ulosteisiin, pääasiassa metaboliitteina. Syproteroniasetaatti sitoutuu melkein kokonaan plasman albumiiniin (noin 3,5 - 4% kokonaisannoksesta on sitoutumaton). Koska proteiiniin sitoutuminen on epäspesifistä, steroidihormonia sitovan globuliinin pitoisuuden muutokset eivät vaikuta syproteroniasetaatin farmakokinetiikkaan. Lääke kertyy hoitojakson aikana. Vakaa tila saavutetaan noin 16 päivän kuluttua. Pitkäaikaisessa käytössä syproteroniasetaatti kerääntyy kaksinkertaiseksi hoidon aikana. Etinyyliestradioli imeytyy nopeasti ja täydellisesti ruoansulatuskanavasta ja metaboloituu hyvin hitaasti. Annoksen antamisen jälkeen etinyyliestradiolin enimmäispitoisuus plasmassa saavutetaan 1,7 tunnin kuluttua. Etinyyliestradiolin pitoisuus plasmassa pienenee kahdessa vaiheessa, joissa T0,5 on vastaavasti 1-2 tuntia ja 20 tuntia. Etinyyliestradioli sitoutuu voimakkaasti, mutta ei spesifisesti, plasman albumiinin kanssa. Ok. 2% pysyy vapaana. Jatkuvassa käytössä etinyyliestradioli indusoi steroidihormoneja sitovan globuliinin ja kortikosteroidia sitovan globuliinin maksan synteesiä.
Annostus
Suun kautta: 1 tabletti pow. päivittäin, samaan aikaan päivästä, 21 päivän ajan. Sitten 7 päivän tauko ennen seuraavan pakkauksen aloittamista. Oireiden lievittämiseen tarvittava aika on vähintään 3 kuukautta. Hoitavan lääkärin on arvioitava säännöllisesti uudelleen hoidon tarve. - Heinäkuun 2013 turvallisuusviestin mukaan. Valmistelut otetaan ensimmäistä kertaa. Valmistelu aloitetaan ensimmäistä kertaa kuukautisten ensimmäisenä päivänä - tämä suojaa ei-toivottua raskautta vastaan jo ensimmäisellä hoitojaksolla. Kun otat ensimmäisen tabletin syklin 5. päivänä, sinun on käytettävä ylimääräisiä ehkäisyvälineitä tai et saa olla yhdynnässä koko ensimmäisen syklin ajan. Tämä sykli voi olla hedelmällinen (mahdollinen ovulaatio sukupuolihormonien erityksen hallinnan riittämätön, liian myöhäinen - 5. päivästä alkaen). 21 päivän kuluttua valmisteen käytössä on 7 päivän tauko ennen seuraavan pakkauksen aloittamista. Kuukautiskierron verenvuodon tulisi esiintyä keskeytysjakson aikana. Riippumatta siitä, onko se ohi, seitsemän päivän kuluttua on otettava seuraavan tabletin ensimmäinen tabletti. Jos olet aiemmin käyttänyt jotakin muuta yhdistelmähoitoa. Valmisteen käyttö on aloitettava seuraavana päivänä senhetkisen 7 päivän tauon jälkeen, joka johtuu nykyisen valmisteen käytöstä, tai seuraavana päivänä sen jälkeen, kun viimeinen inaktiivinen tabletti (ilman hormoneja) on otettu nykyisestä pakkauksesta (potilasta on neuvottava kysymään lääkäriltä tai apteekista, jos epäilet). Jos olet aiemmin käyttänyt minipillereitä (yhden ainesosan pillereitä). Voit lopettaa minipillereiden käytön milloin tahansa ja ottaa lääkkeen sen sijaan samanaikaisesti. Potilaan tulee käyttää muita ehkäisymenetelmiä, jos hänellä on yhdynnässä seitsemän ensimmäisen päivän aikana lääkkeen ottamisesta. Jos olet aiemmin käyttänyt ehkäisyinjektioita, implanttia tai gestageenia vapauttavaa IUD: tä. Sinun tulisi aloittaa valmisteen ottaminen seuraavana injektiona tai implantin tai IUD: n poistamisen päivänä. Jos potilaalla on yhdynnässä seitsemän ensimmäisen päivän kuluessa valmisteen ottamisesta, muita ehkäisymenetelmiä tulee käyttää samanaikaisesti. Valmisteen ottaminen synnytyksen tai luonnollisen tai keinotekoisen keskenmenon jälkeen. Valmisteen käytön tulisi alkaa 21–28 päivää toimituksen jälkeen. Potilailla, joilla on ollut yhdynnässä ennen valmisteen antamista, valmistetta ei tule antaa ennen ensimmäistä luonnollista kuukautista, jotta voidaan varmistaa, että potilas ei ole raskaana. Muita ehkäisymenetelmiä on käytettävä valmisteen ottamisen ensimmäisten 7 päivän aikana. Älä käytä valmistetta imetyksen aikana. Unohtuneiden tablettien hallinta. Jos unohtunut tabletti otetaan 12 tunnin kuluessa, lääkkeen tehokkuus säilyy. Ota tabletti mahdollisimman pian ja ota seuraava tavalliseen aikaan. Jos kulunut aika on yli 12 tuntia, lääkkeen teho voi heikentyä. Siksi on suositeltavaa käyttää muita ehkäisymenetelmiä 7 peräkkäisenä päivänä (7 peräkkäiselle tabletille kuluva aika). Jos potilas on unohtanut ottaa tabletit eikä odotettua verenvuotoa ole esiintynyt ensimmäisen tabletittoman jakson aikana, raskauden mahdollisuus on otettava huomioon. Viikon 1 unohtunut tabletti Ota unohdettu tabletti heti kun muistat, vaikka se merkitsisikin kahden tabletin ottamista samanaikaisesti ja seuraavan ottamista samanaikaisesti. Muita ehkäisymenetelmiä tulee käyttää seuraavien 7 päivän ajan. Jos olet harrastanut seksiä viikon aikana ennen tabletin unohtamista, on olemassa raskausvaara. Viikon 2 unohtunut tabletti Ota unohtunut tabletti heti kun muistat, vaikka tämä merkitsisi kahden tabletin ottamista samanaikaisesti ja seuraavan ottamista samanaikaisesti. Valmisteen ehkäisyteho säilyy eikä muita ehkäisymenetelmiä tarvita. Unohtuneet tabletit viikolla 3 Potilaan on valittava yksi seuraavista vaihtoehdoista: 1. Naisen on otettava unohtunut tabletti mahdollisimman pian ja seuraava tavalliseen aikaan, vaikka tämä merkitsisi kahden tabletin ottamista samanaikaisesti. Tablettien ottaminen seuraavasta pakkauksesta tulee aloittaa heti nykyisen pakkauksen valmistamisen jälkeen, ts. Ilman 7 päivän taukoa valmisteen ottamisessa. Verenvuoto tapahtuu toisen pakkauksen päättymisen jälkeen, mutta saatat kohdata tiputtelua tai kevyttä verenvuotoa tablettien ottopäivinä. 2. Potilas ei myöskään saa enää ottaa tabletteja nykyisestä pakkauksesta, tehdä 7 päivän tai vähemmän tauon (sinun on sisällytettävä myös päivä, jona tabletti jäi väliin) ja jatkaa sitten seuraavalla pakkauksella. Jos potilas on unohtanut ottaa tabletit eikä odotettua verenvuotoa ole esiintynyt ensimmäisen tabletittoman jakson aikana, raskauden mahdollisuus on otettava huomioon. Neuvoja oksentelun tai akuutin ripulin sattuessa. Vaikuttavat aineet eivät välttämättä imeydy kokonaan, jos sinulla on oksentelua tai vaikea ripuli. Jos oksentelua tai vakavaa ripulia ilmenee 3-4 tunnin kuluessa tabletin ottamisesta, edellä mainittuja ohjeita on noudatettava unohdettujen tablettien kohdalla. Menettely kuukautisten vuotamisen alkamisen viivästyttämiseksi. Verenvuoto voi viivästyä, jos aloitat tablettien ottamisen seuraavasta pakkauksesta ilman 7 päivän taukoa. Voit ottaa tabletteja, kunnes pakkaus on loppuun käytetty. Seuraavaa pakkausta käytettäessä saattaa esiintyä verenvuotoa tai tiputtelua. Seuraava pakkaus on aloitettava 7 päivän tauon jälkeen. Menettely, jos aikoo muuttaa kuukautisvuodon päivää. Lykätä verenvuotoa toiseen viikonpäivään kuin annosteluohjelmasi mukaan lyhentämällä seuraavaa tablettivapaata päivien lukumäärällä, jonka haluat verenvuodon lykätä. Mitä lyhyempi tabletteja sisältämätön väli on, sitä suurempi on riski, ettei vieroitusverenvuotoa esiinny. Seuraavan pakkauksen yhteydessä voi esiintyä vähäistä verenvuotoa tai tiputtelua. Odottamaton verenvuoto tapahtuu. Epäsäännöllistä emättimen verenvuotoa (tiputtamista tai kuukautisvuotoa) voi esiintyä muutaman ensimmäisen kuukauden aikana. Jatka kuitenkin tablettien ottamista. Epäsäännöllinen emättimen verenvuoto loppuu yleensä 3 hoitosyklin jälkeen. Jos verenvuoto jatkuu, pahenee tai uusiutuu, sinun tulee ilmoittaa siitä lääkärillesi. Verenvuotoa ei tapahdu. Jos olet ottanut kaikki tabletit oikeaan aikaan, sinulla ei ole ollut voimakasta ripulia tai oksentelua tai käytät muita lääkkeitä, raskauden mahdollisuus on pieni. Hänen tulisi jatkaa valmistelun ottamista. Jos et veritä seuraavien kahden kuukauden aikana, saatat olla raskaana. Potilaan tulee ottaa yhteys lääkäriin välittömästi. Älä aloita seuraavaa pakkausta ennen kuin olet varma, että et ole raskaana.
Käyttöaiheet
Kohtalaisen tai vaikean aknen (seborrhea kanssa tai ilman) hoito, johon liittyy androgeeniherkkyyttä ja / tai hirsutismi naisilla, jotka voivat tulla raskaaksi. Valmistetta tulisi käyttää aknen hoidossa vain, kun paikallinen hoito ja systeeminen antibioottihoito ovat epäonnistuneet. Koska valmiste on myös hormonaalinen ehkäisy, sitä ei tule käyttää yhdessä muiden hormonaalisten ehkäisyvalmisteiden kanssa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai jollekin apuaineelle. Samanaikainen käyttö toisen ehkäisyvalmisteen kanssa. Nykyinen tai aikaisempi laskimotromboosi (syvä laskimotromboosi, keuhkoembolia). Nykyinen tai edellinen valtimotromboosi (esim. Sydäninfarkti) tai prodromaaliset oireet (esim. Angina pectoris ja ohimenevä iskeeminen kohtaus). Nykyinen tai mennyt aivohalvaus. Vakavan riskitekijän tai monien riskitekijöiden esiintyminen laskimo- tai valtimotromboosissa, kuten: diabetes mellitus, johon liittyy verisuonikomplikaatioita, vaikea valtimoverenpainetauti, vaikea dyslipoproteinemia. Perinnöllinen tai hankittu taipumus laskimo- tai valtimotromboosiin, esim. Resistenssi aktiiviselle proteiini C: lle (APC), antitrombiini III: n puutos, proteiini C: n puutos, proteiini S: n puutos, hyperhomokysteinemia ja antifosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupus-antikoagulantti). Historia migreenistä, jossa on fokaalisia neurologisia oireita. Tunnettu tai epäilty rintasyöpä, lisääntymiselimet tai muu hormoniriippuvainen syöpä, läsnä tai aiemmin. Selittämätön verenvuoto emättimestä. Aiempi tai nykyinen vaikea maksan vajaatoiminta niin kauan kuin maksan toimintaparametrit eivät ole palanneet normaaliksi. Nykyinen tai aiemmin esiintynyt maksasyöpä (hyvänlaatuinen tai pahanlaatuinen). Haimatulehdus, nykyinen tai aiemmin, koholla triglyserideillä. Raskaus tai epäilty raskaus. Imetys. Valmistetta ei käytetä miehillä.
Varotoimenpiteet
Valmisteella on samanlainen koostumus kuin yhdistetyillä suun kautta otettavilla ehkäisyvalmisteilla. Oireiden lievittämiseen tarvittava aika on vähintään 3 kuukautta - hoitavan lääkärin on säännöllisesti tarkistettava hoidon jatkamisen tarve. Valmisteen käytössä on oltava erityisen varovainen, jos potilaalla on: diabetes, liikalihavuus, korkea verenpaine, sydänläpän tauti tai sydämen rytmihäiriöt, pintalaskimoiden tulehdus, suonikohjut, migreenikohtaukset, epilepsia, tromboosi, sydänkohtaus tai aivohalvaus lähisukulaisilla, maksa- tai sappirakon tauti, systeeminen lupus erythematosus (SLE), ihon värimuutokset (kellertävän ruskea pigmentaatio, jota kutsutaan kloasmaksi), veren kolesteroli- tai triglyseridipitoisuuden nousu, Crohnin tauti tai haavainen paksusuolitulehdus. Jos jokin näistä oireista ilmenee ja jos hirsutismin oireet ilmaantuvat tai pahenevat, ota yhteyttä lääkäriisi. Jos jokin alla luetelluista olosuhteista tai riskitekijöistä esiintyy, jokaisen naisen tulisi punnita valmisteen käytön edut ja riskit ja keskustella naisen kanssa ennen kuin hän päättää aloittaa valmisteen käytön. Jos jokin näistä tiloista tai riskitekijöistä heikkenee, pahenee tai ilmenee ensimmäisen kerran, naisen tulee ottaa yhteyttä lääkäriinsä, joka päättää, onko valmisteen käyttö lopetettava. Valmisteen käyttöön liittyy lisääntynyt laskimotromboembolian (VTE) riski. VTE: n liiallinen riski on suurin käytön ensimmäisenä vuonna naisilla, jotka aloittavat sen ensimmäisen kerran, ja kun oraalinen ehkäisy aloitetaan uudelleen tai vaihdetaan vähintään yhden kuukauden tabletittoman tauon jälkeen. Laskimotromboembolia voi olla kohtalokas 1-2%: lla. Epidemiologiset tutkimukset ovat osoittaneet, että laskimotromboembolian riski on 1,5–2 kertaa suurempi käyttäjillä kuin levonorgestreelia sisältävien yhdistelmäehkäisytablettien käyttäjillä, ja se voi olla verrattavissa desogestreeliä, gestodeenia tai drospirenoni. Valmistetta käyttävään potilasryhmään voi kuulua potilaita, joilla on luonnostaan lisääntynyt sydän- ja verisuonitautien, kuten munasarjojen monirakkulatauti -riski, riski. Epidemiologiset tutkimukset ovat myös osoittaneet yhteyden hormonaalisten ehkäisyvalmisteiden käytön ja valtimotromboembolian (sydäninfarkti, ohimenevä iskeeminen kohtaus) välillä. Erittäin harvoin ehkäisyvälineiden käyttäjillä on raportoitu muiden verisuonten, esim. Maksan, suoliston, munuaisten, aivojen tai verkkokalvon laskimoiden ja valtimoiden, tromboosia. Laskimotromboembolian kehittymisen riskiä lisääviä tekijöitä ovat: ikä; tupakointi (riski kasvaa lisäksi tupakoitujen savukkeiden määrän lisääntyessä ja iän myötä, etenkin yli 35-vuotiailla naisilla, joille on erittäin suositeltavaa lopettaa tupakointi, jos he aikovat käyttää valmistetta); positiivinen sukututkimus (ts. laskimotromboembolian esiintyminen sisaruksissa tai vanhemmissa suhteellisen nuorena) - jos epäillään geneettistä taipumusta, nainen on lähetettävä asiantuntijalle konsultoitavaksi ennen kuin hän päättää käyttää ehkäisyä; pitkäaikainen immobilisointi, laaja leikkaus, mahdolliset alaraajojen leikkaukset tai vakava trauma - edellä mainituissa tilanteissa on suositeltavaa lopettaa valmisteen käyttö (vähintään 4 viikkoa ennen suunniteltua leikkausta) ja olla aloittamatta valmisteen käyttöä vasta 2 viikkoa sen jälkeen toipuminen, antikoagulanttihoitoa tulee harkita, jos valmistetta ei keskeytetä aikaisin; liikalihavuus (painoindeksi yli 30 kg / m2). Tekijöitä, jotka lisäävät valtimotromboembolian tai aivohalvauksen riskiä, ovat: ikä; tupakointi (riski kasvaa lisäksi tupakoitujen savukkeiden määrän lisääntyessä ja iän myötä, etenkin yli 35-vuotiailla naisilla, joille on erittäin suositeltavaa lopettaa tupakointi, jos he aikovat käyttää valmistetta); dyslipoproteinemia; liikalihavuus (painoindeksiyli 30 kg / m2); verenpainetauti; migreeni; sydämen sydänsairaus; eteisvärinä; positiivinen sukututkimus (valtimotromboottisten häiriöiden esiintyminen sisaruksissa tai vanhemmissa suhteellisen nuorena) - jos epäillään geneettistä taipumusta, nainen on lähetettävä asiantuntijalle konsultoitavaksi ennen kuin hän päättää käyttää ehkäisyä. Muita kardiovaskulaarisiin tapahtumiin liittyviä sairauksia ovat diabetes mellitus, systeeminen lupus erythematosus, hemolyyttinen ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (esim. Crohnin tauti tai haavainen paksusuolitulehdus) ja sirppisoluanemia. Tromboembolian lisääntynyt riski lapsuudessa on otettava huomioon. Migreenin esiintymistiheyden tai vakavuuden lisääminen valmisteen käytön aikana (mikä voi ennustaa aivoverisuonitapahtuman esiintymisen) voi olla syy sen käytön välittömälle lopettamiselle. Suonikohjujen ja pinnallisen tromboflebiitin roolista laskimotromboemboliassa ei ole yksimielisyyttä. Valmistetta käyttäviä naisia on erityisesti korostettava ottamaan yhteyttä lääkäriinsä, jos tromboosioireita ilmenee. Jos epäillään tai vahvistetaan tromboosi, hoito on lopetettava. Sopiva ehkäisymenetelmä on aloitettava antikoagulanttien (kumariinijohdannaisten) teratogeenisten vaikutusten vuoksi. Epidemiologisissa tutkimuksissa on raportoitu lisääntynyttä kohdunkaulan syövän riskiä suun kautta otettavien ehkäisyvalmisteiden pitkäaikaisessa käytössä. Riski ei kuitenkaan välttämättä liity suoraan näiden valmisteiden käyttöön, vaan se voi johtua erityisestä seksuaalisesta käyttäytymisestä tai muista tekijöistä, kuten papilloomaviruksen (HPV) infektiosta. Epidemiologiset tutkimukset ovat osoittaneet, että hormonaalisten ehkäisyvalmisteiden käyttäjillä on hieman lisääntynyt rintasyövän suhteellinen riski. Riski häviää vähitellen 10 vuoden kuluessa hormonaalisten ehkäisyvalmisteiden lopettamisesta. Kun ilmenee vakavia ylävatsavaivoja, maksan suurentumista tai vatsan sisäisen verenvuodon merkkejä, maksakasvaimen mahdollisuus on otettava huomioon erilaistumisessa. Valmisteen tehokkuus voi heikentyä, jos tabletteja unohdetaan, ruoansulatuskanavan häiriöt tai muiden lääkkeiden samanaikainen käyttö. Epäsäännöllisen verenvuodon tapauksessa niiden esiintymisen syiden asianmukainen arviointi on mahdollista vasta kehon sopeutumisjakson jälkeen, joka kestää noin 3 sykliä. Jos epäsäännöllistä verenvuotoa esiintyy tai jatkuu edellisten säännöllisten hoitojaksojen jälkeen, on harkittava ei-hormoniin liittyviä syitä ja suoritettava asianmukaiset diagnostiset testit (tarvittaessa kohdun ontelon kaavinta) pahanlaatuisuuden diagnosoimiseksi tai raskauden määrittämiseksi. Joillakin naisilla ei voi esiintyä vieroitusvuotoa tabletittoman jakson aikana. Valmiste sisältää sakkaroosia - sitä ei tule käyttää potilaille, joilla on harvinainen perinnöllinen fruktoosi-intoleranssi, sakkaroosi-isomaltaasin puutos tai glukoosi-galaktoosin imeytymishäiriö. Valmiste sisältää laktoosia - sitä ei tule käyttää potilaille, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, saamelaisilla esiintyvä laktaasipuutos tai glukoosi-galaktoosin imeytymishäiriö.
Ei-toivottu toiminta
Valmisteen käyttöön liittyy lisääntynyt tromboembolian riski (esiintyvyys - harvinainen). Vakavat haittavaikutukset: laskimotromboembolia; valtimoiden tromboemboliset häiriöt; hormoniriippuvaiset kasvaimet; maksasairaus; systeeminen lupus erythematosus (SLE); korea. Pieniä haittavaikutuksia, joita esiintyy lähinnä valmisteen ottamisen ensimmäisten kuukausien aikana: silmäkipu piilolinssejä käytettäessä; pahoinvointi ja vatsavaivat; painon muutos; päänsärky; muutokset sukupuolihalussa, masennus; tiputtelu tai verenvuoto syklin keskellä; ihottuma, kutina, mykoosi, ihomuutokset, hiustenlähtö; kipu rinnassa.
Raskaus ja imetys
Valmiste on vasta-aiheinen raskauden aikana, jos epäillään raskautta, ja imetyksen aikana. Jos raskaus todetaan käytön aikana, valmiste tulee lopettaa välittömästi.
Kommentit
Ennen valmisteen käytön aloittamista tai sen käytön tauon jälkeen on suoritettava perusteellinen sairaushistoria ja tutkimus, jotta voidaan havaita käytön vasta-aiheet ja ottaa huomioon varoitukset. Säännölliset lääkärintarkastukset tulisi suorittaa säännöllisesti. Lääkäri määrittää testien tiheyden ja tyypin erikseen jokaiselle potilaalle, mutta verenpainetta, rintojen, vatsaontelon ja pienen lantion elinten tilaa, sytologinen tutkimus mukaan lukien, tulisi seurata.
Vuorovaikutukset
Lääkkeet, jotka saattavat vähentää suun kautta otettavien ehkäisyvalmisteiden tehokkuutta: Lääkkeet, jotka voivat vähentää estrogeenien enterohepaattista verenkiertoa ja alentaa etinyyliestradiolin pitoisuutta, esim. Penisilliini ja tetrasykliiniantibiootit (ampisilliini, rifampisiini, griseofulviini); maksaentsyymien induktorit, mukaan lukien ritonaviiri - HIV-infektiolääke, jotkut epilepsian hoitoon käytettävät lääkkeet (esim. primidoni, hydantoiini, fenytoiini, barbituraatit, karbamatsepiini, okskarbamatsepiini, topiramaatti, felbamaatti), mäkikuismaa sisältävät rohdosvalmisteet - sinun ei tule käytä mäkikuismaa sisältäviä rohdosvalmisteita hoidon aikana. Jos edellä mainittuja lääkkeitä käytetään samanaikaisesti suun kautta otettavien ehkäisyvalmisteiden kanssa enintään viikon ajan, tulee käyttää muita ehkäisymenetelmiä sekä niiden käytön aikana että 7 päivän ajan hoidon lopettamisen jälkeen. Rifampisiinilla tai muilla maksaentsyymien indusoijilla samanaikaisesti hoidettavien naisten on käytettävä lisäehkäisyä antibiootin käytön aikana ja 28 päivän ajan sen lopettamisen jälkeen.
Hinta
OC-35, hinta 100% PLN 33,02
Valmiste sisältää ainetta: syproteroniasetaatti, etinyyliestradioli
Korvaava lääke: KYLLÄ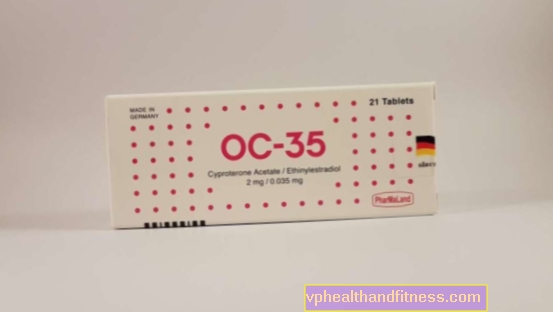








.jpg)